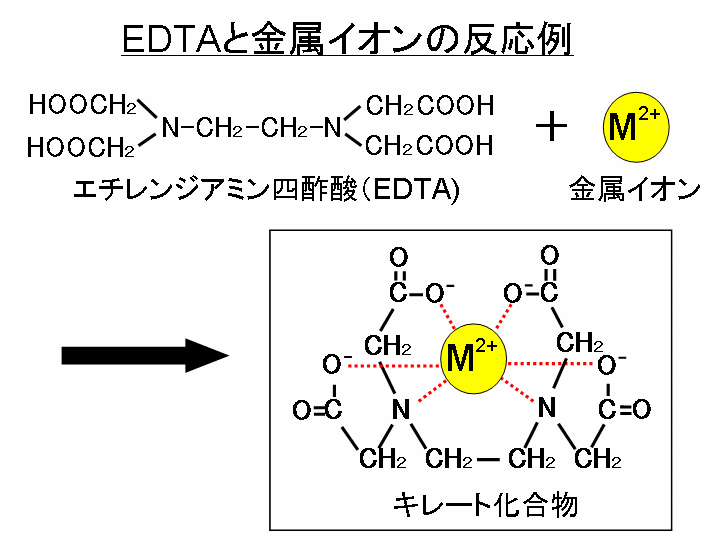
キレート滴定キレートてきてい 試料物質(主として金属イオン)が適当なキレート試薬と反応して キレート化合物 を生成することを利用した滴定法。 1945年Gシュワルツェンバハが創始。 代表的なキレート試薬としては エチレンジアミン 四酢酸水の硬度とは、水に溶けているCa 2+ およびMg 2+ の量をCaCO 3 (ppm)に換算したものである。 硬度には、全硬度(Ca 2+ とMg 2+ )、Ca硬度、およびMg硬度がある。 EDTA(エチレンジアミン四酢酸)は、最大6本の腕(6座配位)で2価~4価の金属イオンと、そのイオンの価数に関係なく1:1で結合し問題28 キレート滴定法による銅と亜鉛の定量 合金は、日々の生活の様々な場面で使用されている。とりわけ、その特性(たとえ ば伝導性,機械的特性あるいは耐食性など)により、合金は航空学,建
水の硬度測定
キレート滴定 計算 銅
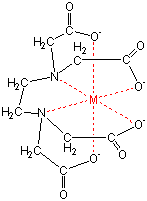
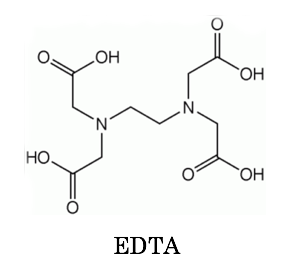
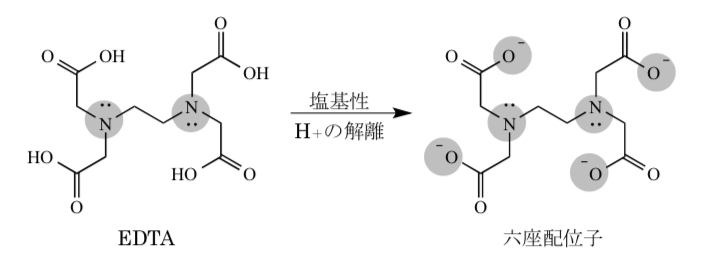
キレート滴定 計算 銅-示薬としてedta溶液で滴定し,edta溶液の正確な濃度を決定する。 4.キレート滴定によるca2+とmg2+の定量 試料水にph 10緩衝液を加え,edta溶液とebt指示薬を用いてキレート滴定を 行い,試料水に含まれるca2+とmg2+の合計量を定量する。キレート滴定に汎用されるキレート試薬;EDTA(六座配位子) ethylenediaminetetraacetic acid エチレンジアミン四酢酸 >NCH 2CH 2N< CH 2 COOH HOOCH C CH 2 COOH HOOCH C EDTAと金属との反応比は1:1 試薬としては 2Na塩を入手 M Y MY K MY = MY/MY キレート生成定数




キレート滴定
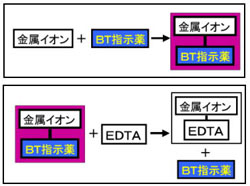
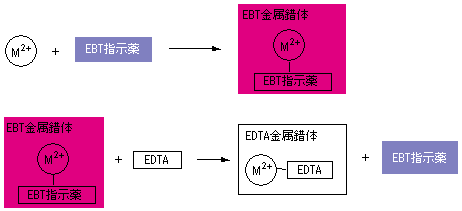
キレート滴定による銅と亜鉛の定量 調整した真鍮の試料溶液5cm3を001mol/L EDTA標準溶液で3回滴定を行った。 3回の滴定の平均は95mlであった。 Cu2+とZn2+のいずれもが、それぞれ1:1でEDTAとキレート化合物を作る1)ので、キレート滴定法は,金属キレート錯体の生成反応を利用して,金属イオン を定量する方法である。たとえば,水道水など飲料水中に含まれるマグネシ ウムおよびカルシウムイオン濃度,すなわち,水の硬度はedta を用いる キレート滴定によって簡単に測定Nn指示薬 キレート滴定の指示薬(錯形成→ 赤:遊離→ 青) edta溶液 滴定剤 有機廃液タンクへ (注ぎ口にろ紙をつけておくこと!) 実験の注意事項 edta滴下 (1) 『ホールピペットで取る』と指定が無いものは大体でok!
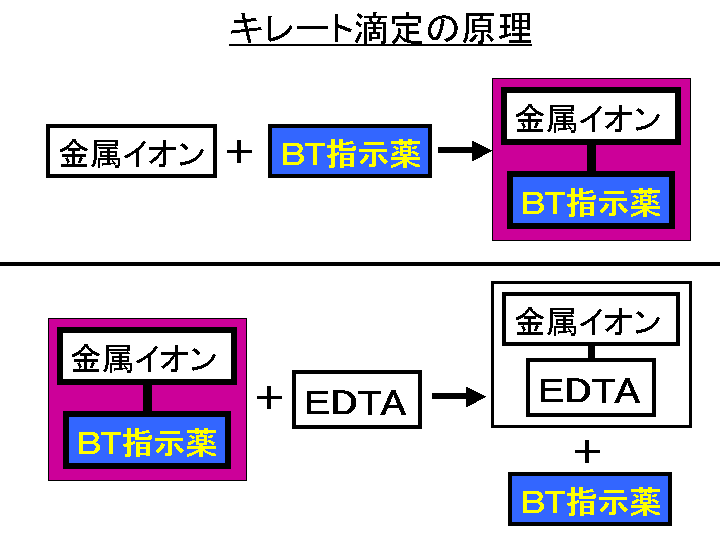
金属イオンの滴定法をキレート滴定法と呼ぶのもそのた めです 3 滴定試薬としての応用(キ レート滴定法) 3・1 キレート滴定法の原理 ふたたび反応式(iii)に ついて考えてみましょう あ る金属イオン(m)の 水溶液にedta溶 液(y)を 滴キレート滴定 エチレンジアミン四酢酸(edta、h 4 yと略記)は、水溶液中で金属イオンと反応し、 非常に安定な金属キレート化合物を作る。 キレート滴定は、そのことを利用した容量分析法である。キレート生成反応は、 である。33.キレート滴定 キレート滴定では、金属イオンとキレート試薬(もっぱらedtaが使われる)が安定な錯体を作ることを利用する。 したがって、たとえば ebt の場合は滴定の終点として、完全に赤みの消えたところを取る。 キレート滴定では、ph の設定に
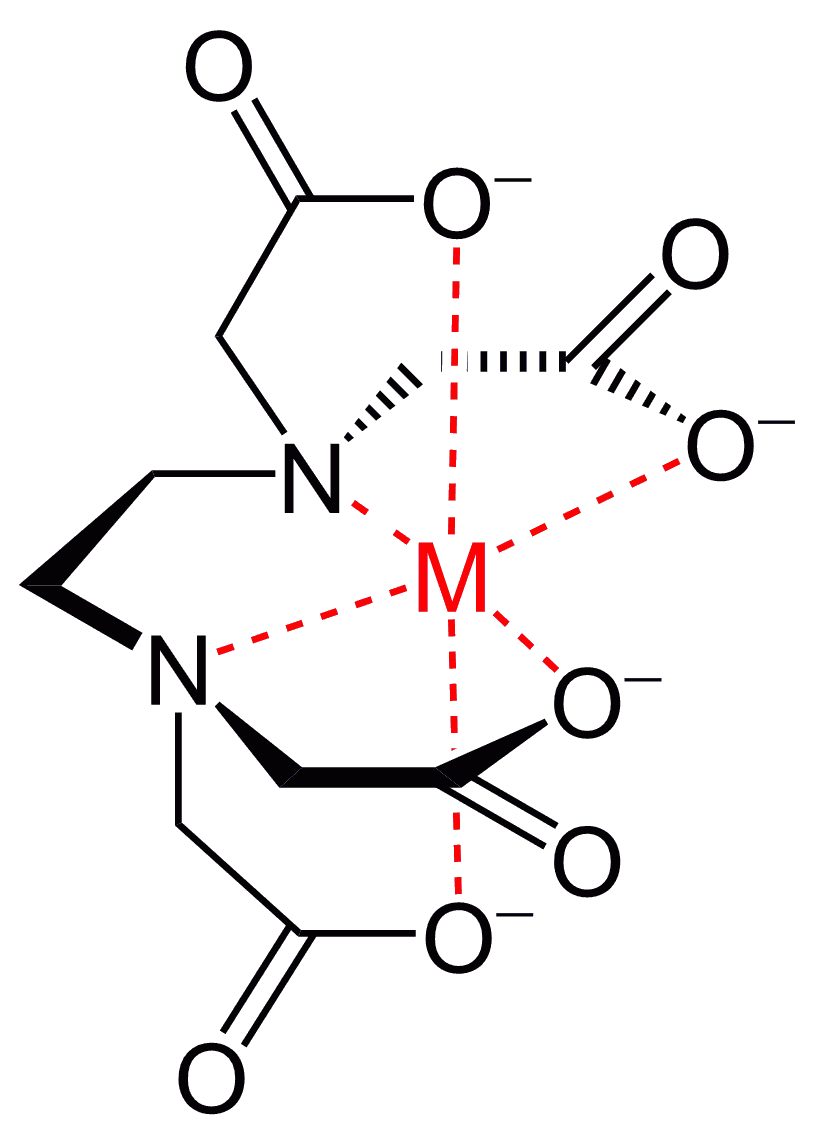
質問箱 名前: 芦田 実 日時:02年09月22日 14時50分 岸本 博文 様 必ずしも専門家ではありませんので,不正確な回答もあります.教育学部から公開しているホームページの質問箱とQ&A集にも回答(一部)を載せたいと思います. 質問18 キレート滴定法Q18 キレート滴定法で行う硬度分析. q17 電解水をよう素滴定法で分析する原理. q10 塩化亜鉛水溶液に塩酸を少量加え,亜鉛板と銅板を接触させて入れて高温を保つと,銅に亜鉛が析出する理由.2.キレート効果 (text p) 二座以上の配位子が金属イオンを挟むような形で錯体を形成するとき,中心金属と配位原子を含む環 ができる.このような錯体をキレート(金属キレートあるいはキレート化合物)とよぶ.




1000以上 キレート滴定 計算 銅 キレート滴定 計算 銅




自動滴定装置 技術資料 銅イオン選択性電極を用いたキレート滴定 メトロームジャパン イプロスものづくり
垢と平衡になる。(01モルの場合)。後 の滴定操作に従 う場合,銀,銅および亜鉛またほカドミウムの全部をシ アノ錯塩としてなお過剰に kcn を加えることはない から,カドミウムまたほ亜鉛の一部がたとえシアン化物 となってもedta滴定は十分進行することが工学基礎化学実験 比色分析 ≪真ちゅう釘中の銅の定量≫ 実験目的 硫酸銅水溶液中の銅イオンをキレート滴定によって求める。Cu2イオンにアンモニアを加えると深青色のアンミン銅錯イオンが生成する。この発色を利用して,濃度が既知のアンミン銅錯イオンの水溶液により,分光光度計をJPB2 JPA JPA JPB2 JP B2 JP B2 JP B2 JP A JP A JP A JP A JP A JP A JP B2 JP B2 JP B2 Authority JP Japan Prior art keywords concentration solution copper plating ion chelating agent Prior art date Legal status




自動滴定装置 技術資料 銅イオン選択性電極を用いたキレート滴定 技術資料 事例集 カタログ メトロームジャパン Powered By イプロス
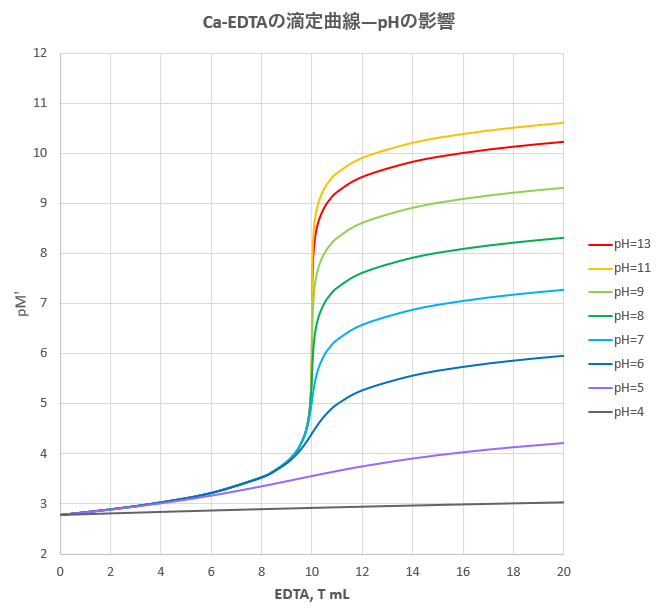



カルシウムのedta滴定 2 滴定曲線 溶解度などーエクセルを用いて
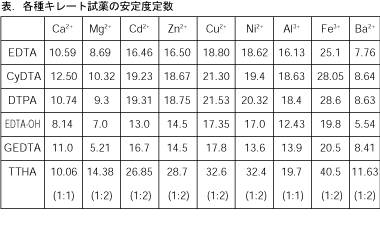
銅めっき反応の標準電極電位 (+034 v)は,水素(0v)より貴な電位であるため, 水素が発生する過電圧より低い電圧で,供給された電気 量のすべてを銅めっきに消費し,水素の発生を伴わずに めっきが可能である。しかし,硫酸銅のみの溶液では銅EDTA と金属キレートのK f 値→p18, 表12 <例:EDTA とMg2> K f = 49×108 log K f = 8 log 49 = 869 ML n M Ln 8 キレート滴定 多座配位子EDTA(標準液)が 金属イオン(Zn 2, Mg 2, Ca , Al3, Cu 等)と 水溶液中で安定な可溶性のキレート化合物を生成する ことを利用したキレート滴定 1.目的 キレート滴定法を用いて、未知試料中に含まれる金属イオン(Ca 2+、Mg 2+)の濃度 を調べ、さらに水の硬度についても計算して求める。また、実験を通してキレート滴定法 の原理や操作の仕方について学び、結果の考察をしてさらに理解を深める。



2



50 金属指示薬 金属指示薬 一覧 Roberthebbjp
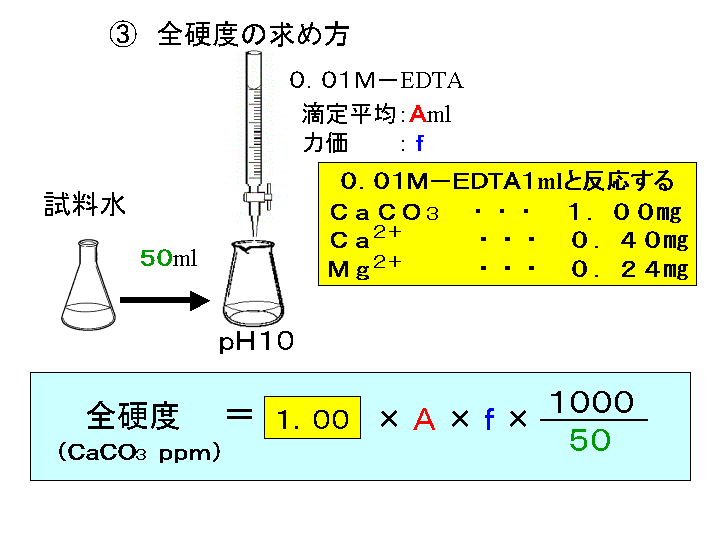
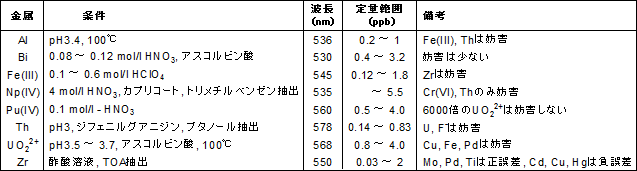
ビュレットの0.01M-EDTA標準溶液で滴定を行う。 溶液の色が赤紫色から青色になったところを終点とする。 6) 1~5を3回繰り返し、滴定平均値を求める。 7) Ca硬度を計算し求める。 8) Mg硬度を計算し求める。キレート滴定ではpH により試料と滴定試薬との反応性が変化するため、pH 調節は規定通り ・コバルト、ニッケル、銅、亜鉛、カドミウム、水銀 : 80g/Lシアン化ナトリウム溶液2mLを添加 上記の計算式で、カルシウム、マグネシウムの合量およびキレート滴定 計算 銅 キレート滴定 計算 銅JPB2 JPA JPA JPB2 JP B2 JP B2 JP B2 JP A JP A JP A JP A JP A JP A JP B2 JP B2 JP B2 Authority JP Japan Prior art keywords concentration solution copper plating ion chelating agent Prior art date Legal statusEDTA と金属キレートのK f 値→p18, 表12 <例:EDTA とMg2> K f




キレート滴定



2
金属キレート (i) キレート滴定用 金属指示薬 (cupan) (j) 化合物を取扱うことになりますこ のように メッキ化学は錯体化学によって成り立ってい ます以下,"キレート化学は専門外だ"とい われる読者のためのキレート化学講座を始め 現パ699キレート滴定の手法は、「銅及び銅合金中のニッケル定量方法」jis h 1056 を参照し、一定量の edta を加えてニッケルの edta 錯体を生成させた後、過剰の edta を亜鉛の溶液で滴定するという、逆滴定を採用しました。 ただし亜鉛の標準溶液を作るのが手間なのとなる。 キレート滴定では、この至適 pH を保つために緩衝液が用いられる! XIII13 補助錯化剤 一般にキレート滴定はかなり高い pH で行なうが、このとき金属水酸化物を沈殿させな いように、 EDTA より Kf の小さい錯化剤(=補助錯化剤 )を共存させることが



水の硬度測定 キレート滴定




キレート滴定法の意味 用法を知る Astamuse
24 電位差滴定法 担当:錯体物性化学 越山 @mboxnckyushu友美 <koshiuacjp>銅イオンCu2は妨害しますがチオ尿素またはチオ硫酸 ナトリウムを加えることによってマスキングできます。 キーワード:亜鉛イオン、光度滴定、キレート滴定 滴定曲線例 測定結果 試料量 滴定値 亜鉛イオン濃度 (mL) (mL) (g/L) 5348 7030 50 5349 7029本稿では、銅イオン電極を用いて、キレート滴定によるめっき液中の銅イオンを測定した事例に ついて紹介します。 2.装置構成および試薬 (1)装置構成 本体 : 平沼自動滴定装置 com シリーズ 電極 : 銅イオン電極 cui081




定量分析実習の実習内容 化学技術科 和歌山工業高校



2
滴定用キレート試薬として、ドータイト2na(edta2ナトリウム 塩)、その他ドータイト金属指示薬、キレート滴定用補助試薬など、 キレート滴定に必要な試薬類は全部とりそろえているので、ご利 用いただきたい。 nc h2ch2 n ch 2cooh hoocch2 ch2cooh hooc 2 on o n m ch2 ch23.edtaによるキレート滴定 競技では,edtaによるキレート滴定の原理やebt指示薬やnn指示薬を用いてca2+ やmg2+ を定量する具体的な方法を問題文の1,2ページに記載し,初学者にも充分理解で きるように配慮した。次に実験操作の手順を簡潔に示す。京都大学 全学共通教育 基礎化学実験ホームページ:http//wwwchemzenkyohkyotouacjp/化学実験操作法:操作法 2 4 キレート




1 3キレート滴定 亜鉛 Ii Edta 塩化銅 Ii Edta のキレート滴定法を学ぶ



2
各種滴定・イオン交換法 担当:反応分析化学 竹原takehara@chemkyushu公 <univjp>よって銅クロロ錯体の生成定数が大きくなるためと考 えられる。これにより銅と亜鉛の分離は著るしく改善 された。しかし,鉄,鉛およびカドミウムは溶出液に 混入してくるので,キレート滴定を行なうさいには適 当なマスキング剤の併用を必要とする。5 銅電解重量法(硝酸・硫酸法) 7 51 要旨 7 52 試薬 7 53 器具 7 54 試料はかりとり量 9 55 操作 9 56 空試験 12 57 計算 12 58 許容差 13 6 銅電解重量法(硝酸・ふっ化水素酸・ほう酸法) 13 61 要旨 13 62 試薬 13
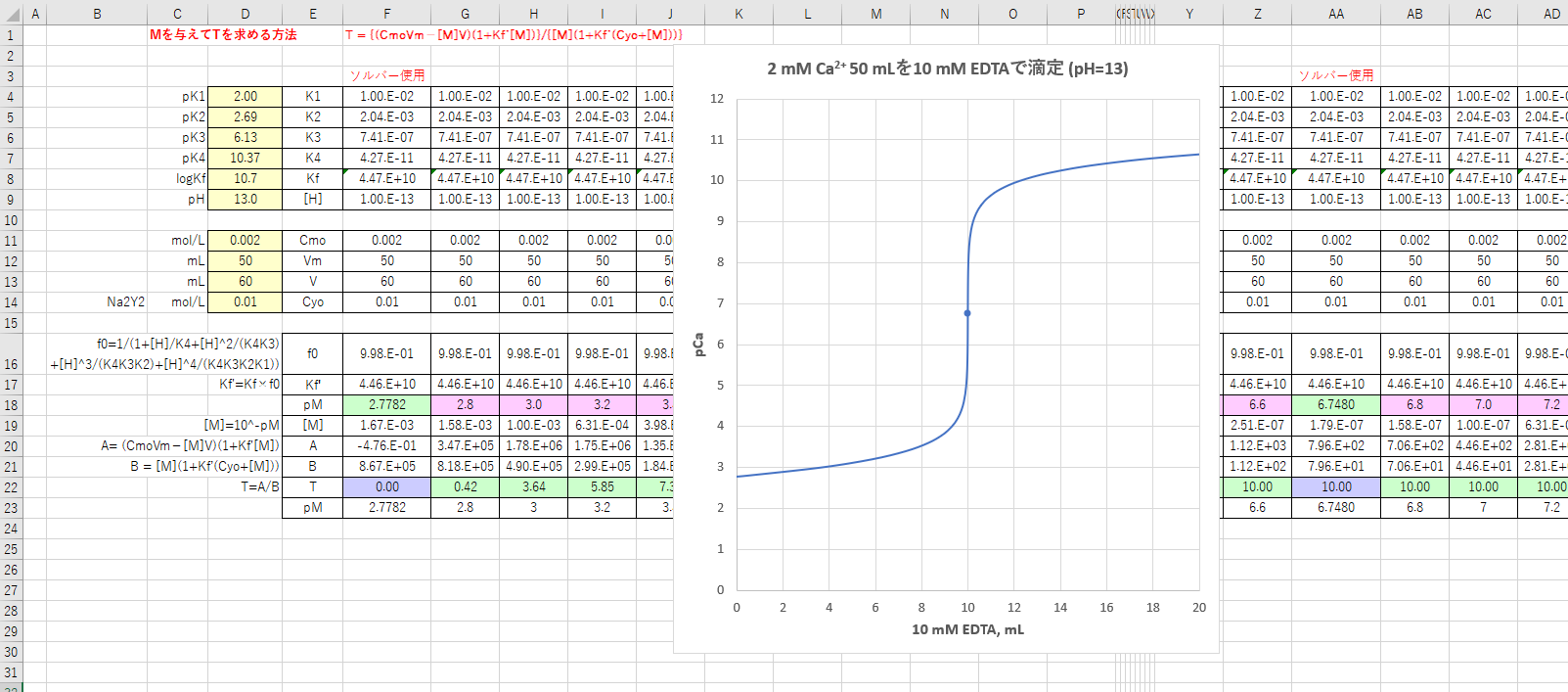



カルシウムのedta滴定 1 滴定曲線 溶解度などーエクセルを用いて




比色試薬 金属指示薬 Pan 同仁化学研究所
I キレート滴定による亜鉛イオン濃度の決定 1 キレート滴定におけるチオ硫酸ナトリウムの役割を説明せよ。 2 滴定の結果に基づき試料中の亜鉛イオンの濃度を求めよ。 ii ヨウ素還元滴定による銅イオン濃度の決定 1 滴定過程の化学反応式を書け。 2キレート滴定の基礎(Ⅰ) キレート滴定の基礎(Ⅰ) 天 満 照 郎※ 1 はしがき キレート滴定法が創始されてから 年,多くの金属の 定量に利用され,その有用性は増大の一途をたどってい る。edta のような優れたキレート化剤が安価に入手で




自動滴定装置 技術資料 銅イオン選択性電極を用いたキレート滴定 メトロームジャパン Powered By イプロス



キレート滴定



Kumadai Repo Nii Ac Jp




17 号 キレート剤の定量方法 Astamuse




水の硬度測定
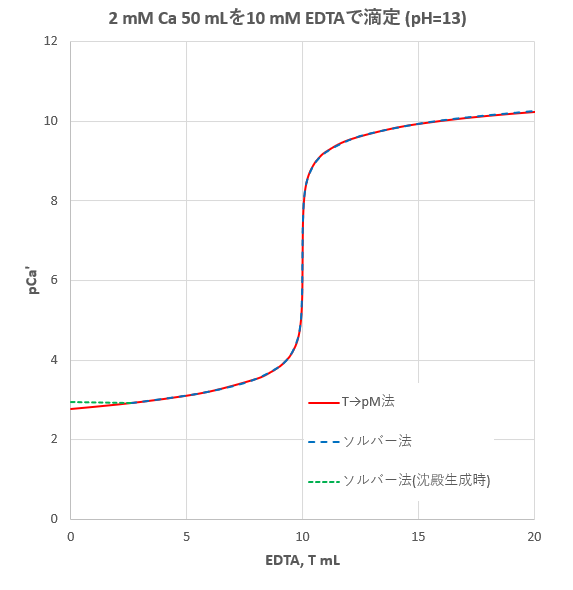



カルシウムのedta滴定 2 滴定曲線 溶解度などーエクセルを用いて




アプリの紹介 キレート滴定曲線 車輪の再発見みたいな
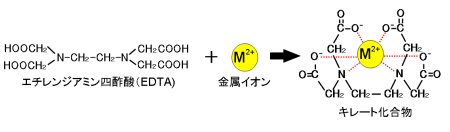



水の硬度測定 キレート滴定



水の硬度測定 キレート滴定




試薬とは コトバンク



1
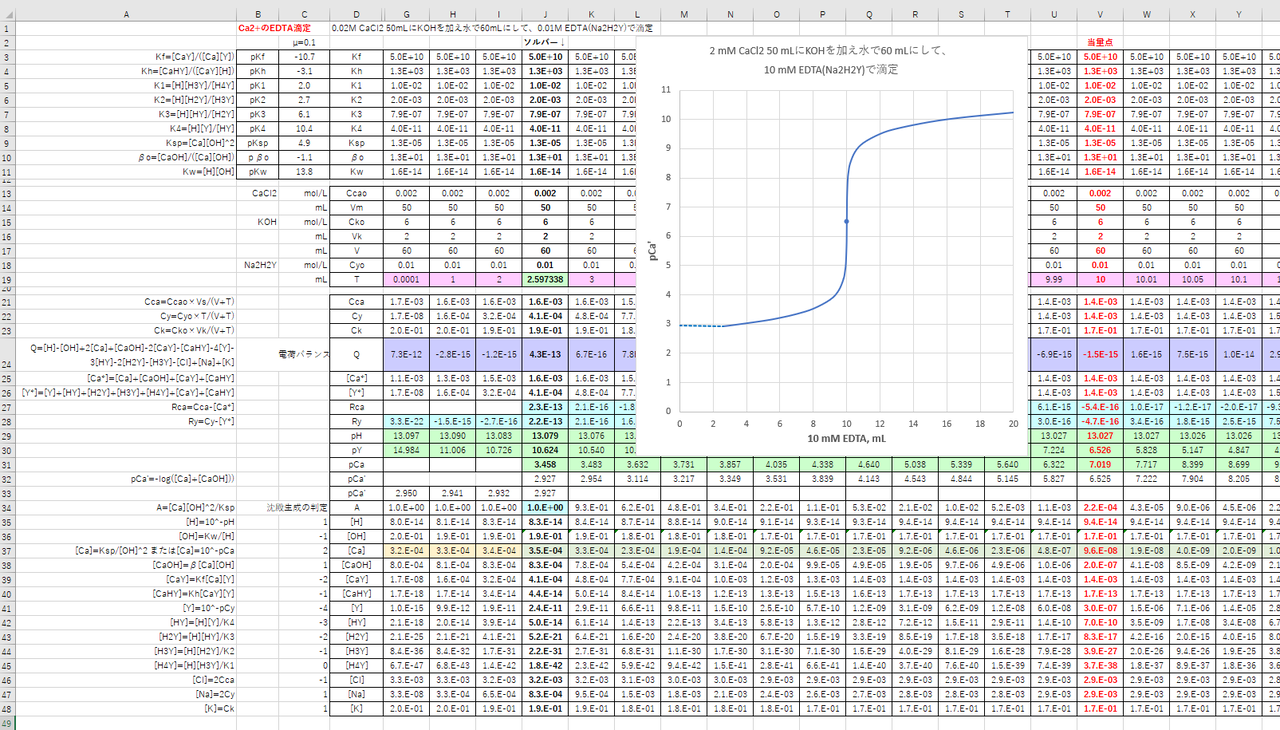



カルシウムのedta滴定 1 滴定曲線 溶解度などーエクセルを用いて




Ym7qe8cfeh7opm




キレート滴定



キレート滴定 Yakugaku Lab




資料広場 代表キーワード キレート滴定 全ての種類 最新資料 詳細リスト ハッピーキャンパス



2cのページ




自動滴定装置 技術資料 銅イオン選択性電極を用いたキレート滴定 メトロームジャパン イプロスものづくり



Column
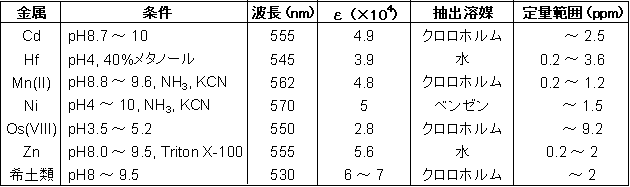



比色試薬 金属指示薬 Pan 同仁化学研究所




キレート滴定




17 号 キレート剤の定量方法 Astamuse
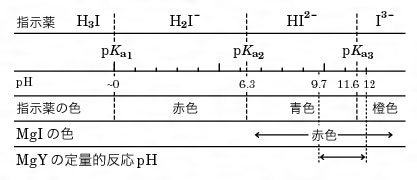



キレート滴定とは コトバンク



2



水の硬度 株式会社ユニケミー ユニラボ




水道水と飲料水の硬度測定 硬度 キレート滴定 マスキング剤 Transblog



3回生実験のこと 合金の分析
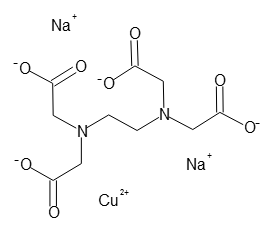



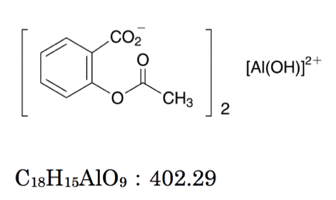
398 15 6 エチレンジアミン N N N N 四酢酸銅 Ii 二ナトリウム塩四水和物 Ethylenediamine N N N N Tetraacetic Acid Copper Ii Disodium Salt Tetrahydrate Cu Ii Edta 341 001 349 002 詳細情報 試薬 富士フイルム和光純薬
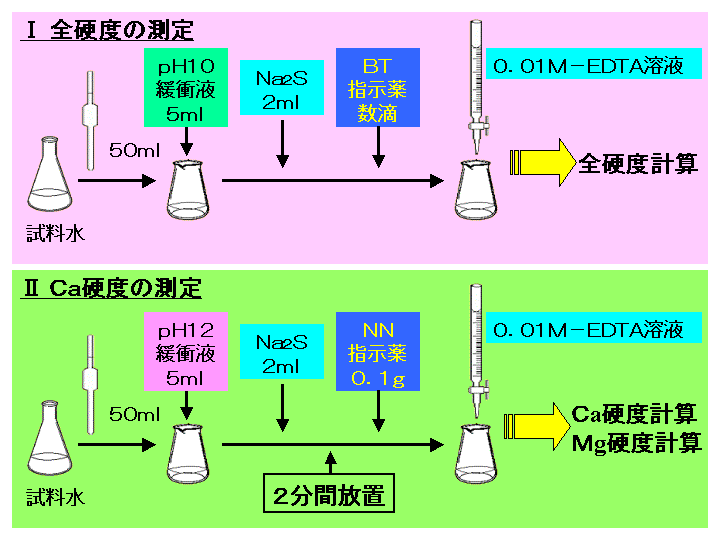



水の硬度測定 キレート滴定



電極 電位差自動滴定装置 製品情報 京都電子工業株式会社



2




17 号 キレート剤の定量方法 Astamuse




キレート滴定 資料検索 資料 全ての資料 全ての種類 関連順 詳細リスト ハッピーキャンパス



水の硬度測定 キレート滴定



キレート Wikipedia




比色試薬 金属指示薬 Bt 同仁化学研究所




金属指示薬とは コトバンク



比色試薬 金属指示薬 Xo 同仁化学研究所




水道水と飲料水の硬度測定 硬度 キレート滴定 マスキング剤 Transblog




17 号 キレート剤の定量方法 Astamuse



キレート滴定 Yakugaku Lab



水の分析




キレート滴定




比色試薬 金属指示薬 Pan 同仁化学研究所



キレート滴定の問題です よろしくお願いします Yahoo 知恵袋




京都大学 化学実験操作法 操作法 2 4 キレート滴定 Mg イオンの定量 Youtube




自動滴定装置データ資料 めっき液中の銅イオンの定量 Hiranuma イプロスものづくり



1



年11月発行 カルシウム塩のキレート滴定について




キレート滴定 英語 意味 英語訳 日本語の例文



水の硬度測定
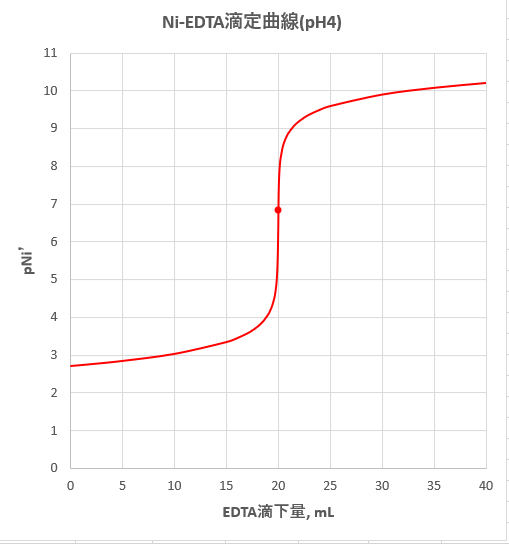



ニッケルのedta滴定 1 滴定曲線 溶解度などーエクセルを用いて




比色試薬 金属指示薬 Nn 同仁化学研究所




17 号 可搬型滴定装置 Astamuse



キレート滴定




Cancelo キレート滴定 No Twitter
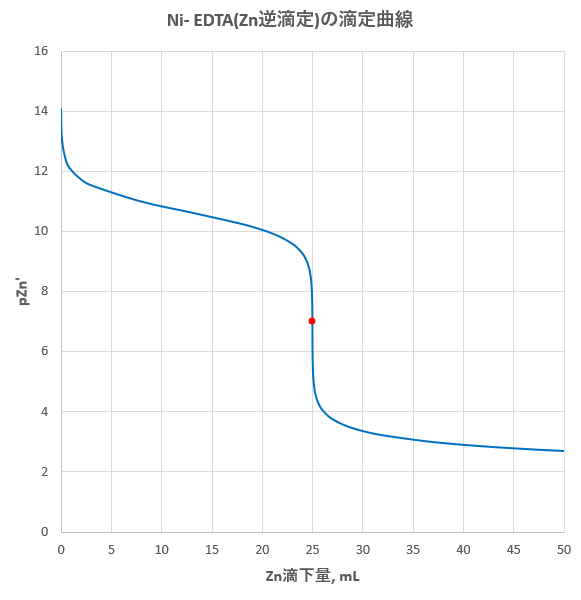



ニッケルのedta滴定 2 滴定曲線 溶解度などーエクセルを用いて




メイラード反応 高ph 高温 高水分で反応が促進される 薬剤師が教える健康情報ブログ



3回生実験のこと 合金の分析




キレート滴定




キレート滴定



2



キレート滴定の問題で Bt指示薬を使ってcaとmgの混合溶液のmgだけの濃度 Yahoo 知恵袋




キレート滴定 銅の定量 Youtube



学生実験をみてみよう 第2期 その5 キレート滴定 江頭教授 東京工科大学 工学部 応用化学科 ブログ




キレート滴定
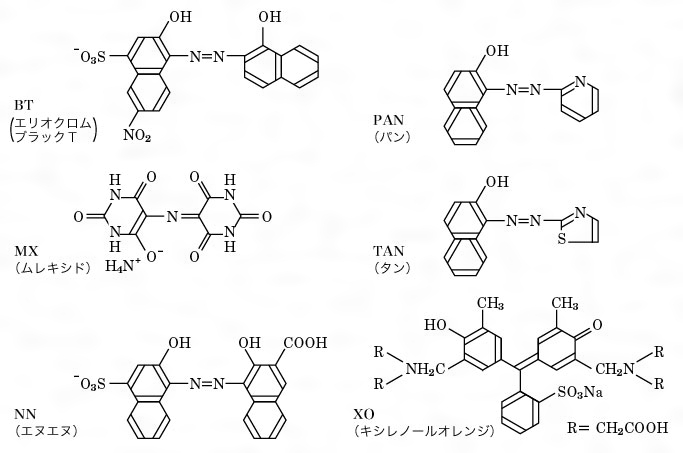



金属指示薬とは コトバンク



キレート滴定で水の中のカルシウムイオンの定量を調べる実験 Yahoo 知恵袋



キレート滴定とは コトバンク




金属指示薬とは コトバンク
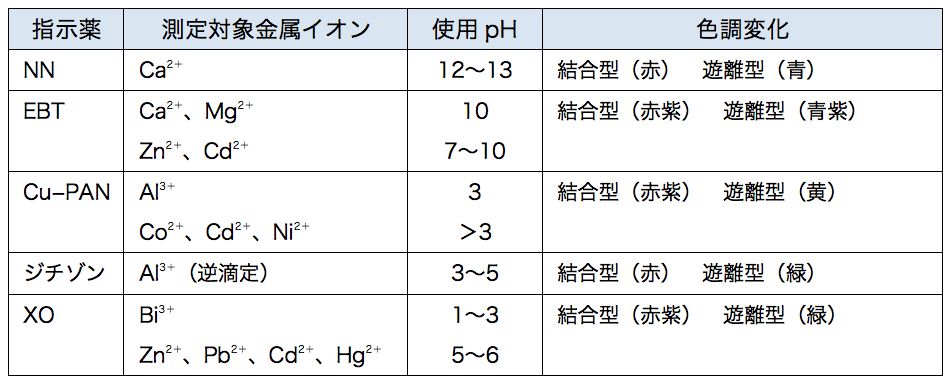



キレート滴定 Yakugaku Lab




キレート滴定




17 号 キレート剤の定量方法 Astamuse



2
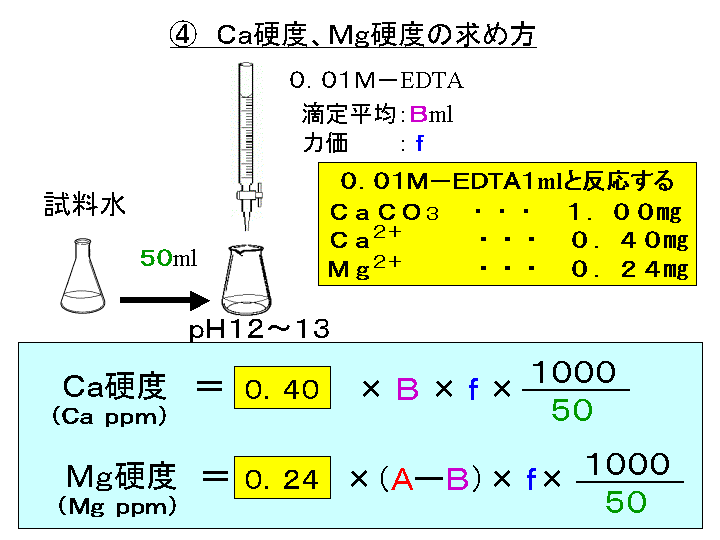



水の硬度測定 キレート滴定



2



Cuのキレート滴定についての質問です 試料溶液として硫酸銅水溶液 標準溶 Yahoo 知恵袋



比色試薬 金属指示薬 Xo 同仁化学研究所
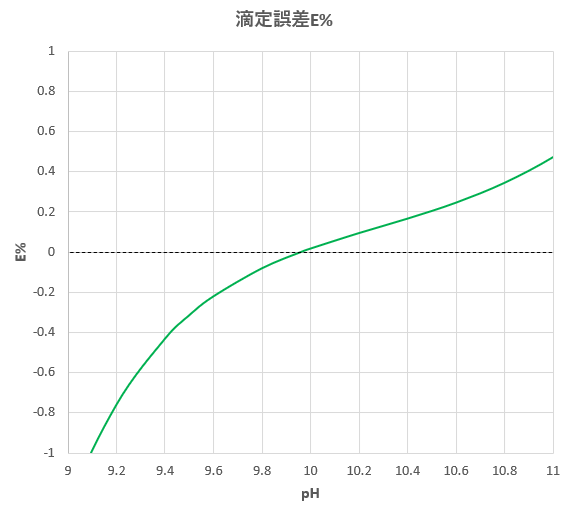



Edta滴定における金属指示薬と滴定誤差 滴定曲線 溶解度などーエクセルを用いて




キレート滴定 Yakugaku Lab




水の硬度測定 キレート滴定



2cのページ



1
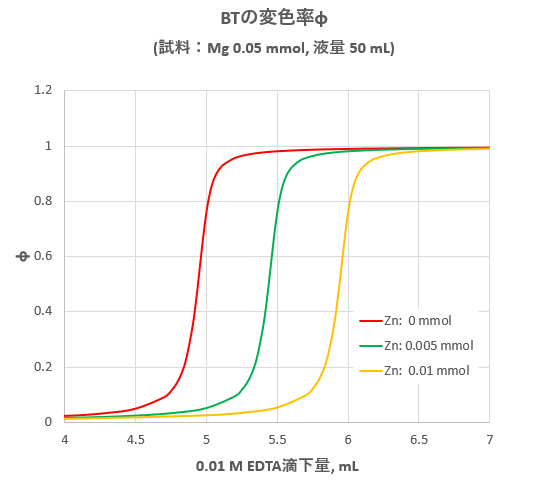



Edta滴定における妨害金属イオンのマスキング 滴定曲線 溶解度などーエクセルを用いて



キレート滴定



水の硬度測定 キレート滴定



薬剤師国家試験 第105回 問92 過去問解説 E Rec わかりやすい解説動画



キレート滴定の濃度計算問題についてです 解き方がわからないので 教えていただ Yahoo 知恵袋



0 件のコメント:
コメントを投稿